- Analizar las propiedades físicas y químicas de los ácidos carboxílicos mediante algunas pruebas.
- Realizar pruebas de solubilidad a ácidos carboxílicos.
- Realizar distintas pruebas químicas a los ácidos carboxílicos.
Resumen: realizamos diferentes pruebas físicas y químicas a nuestras muestras de ácidos carboxílicos ( prueba de solubilidad, de oxidacion, de reactivo de tollens) para determinar, y determinamos las características pertenecientes a estos ácidos.
Marco teórico:
- Propiedades físicas
Los ácidos carboxílicos hierven a temperaturas muy superiores que los alcoholes, cetonas o aldehídos de pesos moleculares semejantes. Los puntos de ebullición de los ácidos carboxílicos son el resultado de la formación de un dímero estable con puentes de hidrógeno.
Los ácidos carboxílicos que contienen más de ocho átomos de carbono, por lo general son sólidos, a menos que contengan dobles enlaces. La presencia de dobles enlaces (especialmente dobles enlaces cis) en una cadena larga impide la formación de una red cristalina estable, lo que ocasiona un punto de fusión más bajo.
Puntos de fusión.
Los ácidos carboxílicos forman puentes de hidrógeno con el agua, y los de peso molecular más pequeño (de hasta cuatro átomos de carbono) son miscibles en agua. A medida que aumenta la longitud de la cadena de carbono disminuye la solubilidad en agua; los ácidos con más de diez átomos de carbono son esencialmente insolubles.
Los ácidos carboxílicos son muy solubles en los alcoholes, porque forman enlaces de hidrógeno con ellos. Además, los alcoholes no son tan polares como el agua, de modo que los ácidos de cadena larga son más solubles en ellos que en agua. La mayor parte de los ácidos carboxílicos son bastante solubles en solventes no polares como el cloroformo porque el ácido continua existiendo en forma dimérica en el solvente no polar. Así, los puentes de hidrógeno de dímero cíclico no se rompen cuando se disuelve el ácido en un solvente polar.
Medición de la acidez
Un ácido carboxílico se puede disociar en agua para dar un protón y un ión carboxilato. La constante de equilibrio Ka para esta reacción se llama constante de acidez. El pKa de un ácido es el logaritmo negativo de Ka, y normalmente se usa al pKa como indicación de la acidez relativa de diferente ácidos.
Solubilidades.
Un sustituyente que estabilice al ión carboxilato, con carga negativa, aumenta la disociación y produce un ácido más fuerte. De este modo los átomos electronegativos aumentan la fuerza de un ácido. Este efecto inductivo puede ser muy grande si están presentes uno o más grupos que atraen electrones en el átomo de carbono alfa.
La magnitud del efecto de un sustituyente depende de su distancia al grupo carboxilo. Los sustituyentes en el átomo de carbono alfa son los más eficaces para aumentar la fuerza de un ácido. Los sustituyentes más distantes tienen efectos mucho más pequeños sobre la acidez, mostrando que los efectos inductivos decrecen rápidamente con la distancia.
Sales de ácidos carboxilicos.
Una base fuerte puede desprotonar completamente en un ácido carboxílico. Los producto son el ión carboxilato, el catión que queda de la base, y agua. La combinación de un ión carboxilato y un catión constituyen la sal de un ácido carboxílico.

Efectos de los sustituyentes sobre la acidez.
Los alcoholes o aldehídos primarios se oxidan normalmente para producir los ácidos empleando ácido crómico. El permanganato de potasio se emplea en ocasiones pero con frecuencia sus rendimientos son inferiores.

Oxidación de alcoholes y aldehidos.
El permanganato de potasio reacciona con los alquenos para dar glicoles. Las soluciones calientes y concentradas de permanganato de potasio oxidan más los glicoles, rompiendo el enlace carbono-carbono central. Dependiendo de la sustitución del doble enlace original, se podrán obtener cetonas o ácidos.

La ozonólisis o una oxidación vigorosa con permanganato rompe el triple enlace de los alquinos dando ácidos carboxílicos.
- Propiedades químicas
El comportamiento químico de los ácidos carboxílicos esta determinado por el grupo carboxilo -COOH. Esta función consta de un grupo carbonilo (C=O) y de un hidroxilo (-OH). Donde el -OH es el que sufre casi todas las reacciones: pérdida de protón (H+) o reemplazo del grupo –OH por otro grupo
|
| Síntesis de los ácidos carboxílicos | ||
Los ácidos carboxílicos pueden obtenerse a partir de reacciones químicas como la oxidación de alcoholes primarios, de los compuestos alquil-bencénicos y por la hidrólisis de nitrilos entre otras. | ||
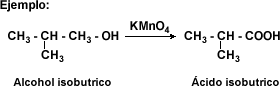
Oxidación de alcoholes primarios: para obtener ácidos carboxílicos mediante esta reacción, el alcohol primario se trata con un agente oxidante fuerte donde el alcohol actúa como un agente reductor oxidándose hasta ácido carboxílico.
| ||
Oxidación de los compuestos alquil-bencénicos: la oxidación de los derivados alquil-bencénicos con mezclas oxidantes fuertes llevan a la formación de ácidos carboxílicos.
| ||
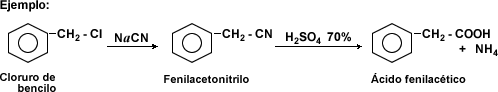
Hidrólisis de Nitrilos: los nitrilos se hidrolizan al ser sometidos a ebullición con ácidos minerales o álcalis en solución acuosa, generando ácidos carboxílicos mediante sustitución nucleofílica.
| ||
| Derivados de los Ácidos Carboxílicos: Los derivados carboxílicos son compuestos que presentan el grupo acilo o el grupo aroilo en los ácidos alifáticos o aromáticos. | |
Entre los derivados de los ácidos carboxílicos se encuentran: las sales de ácido, los ésteres, los haluros de ácidos, anhídridos de ácidos, amidas e imidas | ||
Materiales y Reactivos:
- gradilla
- tubos de ensayo
- mechero
- tubo de desprendimiento lateral
- pinzas para tubos de ensayo
- ácido fórmico
- ácido esteárico
- ácido salicílico
- ácido benzoico
- tinta ordinaria
- ácido sulfúrico
- solución de KMnO4
- Etanol
- solución de CuSO4 al 1%
- solución diluida de NaOH
Diseño Experimental:
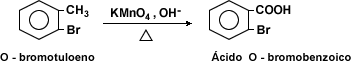
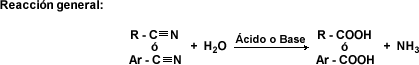
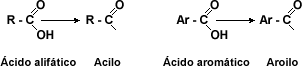



Muy útil sobretodo las propiedades físicas suuper!
ResponderEliminar