ÁCIDO BENZÓICO Y BENZOATO DE SODIO
Objetivos:
- Observar mediante la experiencia en el laboratorio las propiedades físicas y químicas de los ácidos carboxílicos en este caso el ácido benzóico.
- Comprender como se da la formación de una sal de un ácido carboxílico.
Resumen:
Realizaremos algunas pruebas sencillas al ácido benzóico, para así analizar las propiedades características de los ácidos carboxílicos, y formaremos la sal benzoato de sodio para comprender como se obtiene.
Marco teórico
Los compuestos que contienen al grupo carboxilo son ácidos y se llaman ácidos carboxílicos.
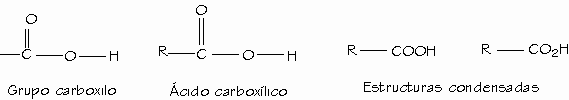
Propiedades físicas:
Los ácidos carboxílicos hierven a temperaturas muy superiores que los alcoholes, cetonas o aldehídos de pesos moleculares semejantes. Los puntos de ebullición de los ácidos carboxílicos son el resultado de la formación de un dímero estable con puentes de hidrógeno.
Los puntos de fusión de los ácidos dicarboxílicos son muy altos. Teniendo dos carboxilos por molécula , las fuerzas de los puentes de hidrógeno son especialmente fuertes en estos diácidos: se necesita una alta temperatura para romper la red de puentes de hidrógeno en el cristal y fundir el diácido.
Los ácidos carboxílicos forman puentes de hidrógeno con el agua, y los de peso molecular más pequeño (de hasta cuatro átomos de carbono) son miscibles en agua. A medida que aumenta la longitud de la cadena de carbono disminuye la solubilidad en agua; los ácidos con más de diez átomos de carbono son esencialmente insolubles.
Los ácidos carboxílicos son muy solubles en los alcoholes, porque forman enlaces de hidrógeno con ellos. Además, los alcoholes no son tan polares como el agua, de modo que los ácidos de cadena larga son más solubles en ellos que en agua. La mayor parte de los ácidos carboxílicos son bastante solubles en solventes no polares como el cloroformo porque el ácido continua existiendo en forma dimérica en el solvente no polar. Así, los puentes de hidrógeno de dímero cíclico no se rompen cuando se disuelve el ácido en un solvente polar.
Una base fuerte puede desprotonar completamente en un ácido carboxílico. Los productos son el ión carboxilato, el catión que queda de la base, y agua. La combinación de un ión carboxilato y un catión constituyen la sal de un ácido carboxílico.

Materiales y reactivos:
- tubo de ensayo
- probeta pequeña.
- gotero.

- mechero bunsen
- pinzas para tubos de ensayo.

- ácido benzóico. toxicidad: ficha de seguridad del ácido benzóico.
- hidróxido de sodio. toxicidad:ficha de seguridad de hidróxido de sodio
- ácido clorhídrico.toxicidad: ficha de seguridad del ácido clorhídrico.
Procedimieno:
- coloque una pequeña cantidad de ácido benzóico en un tubo de ensayo.
- agregue 5 ml de agua.
- caliente hasta que hierva.
- enfríe a temperatura ambiente.
- agregue gota a gota NaOH al 10%
- añada HCL al 10% (la misma cantidad que utilizó de NaOH)
Resultados:
1. ¿Es soluble el ácido benzóico en agua?
2. ¿Se disuelve luego de ser calentado?
3. ¿Qué sucede cuando se deja enfríar a temperatura ambiente?
4. ¿Qué efecto causa el hidróxido de sodio sobre el ácido benzóico? escriba las ecuaciones.
5. ¿Qué sucede al agregar el HCL?
6. ¿Qué le hizo el ácido clorhídrico al ión benzoato?


No hay comentarios:
Publicar un comentario